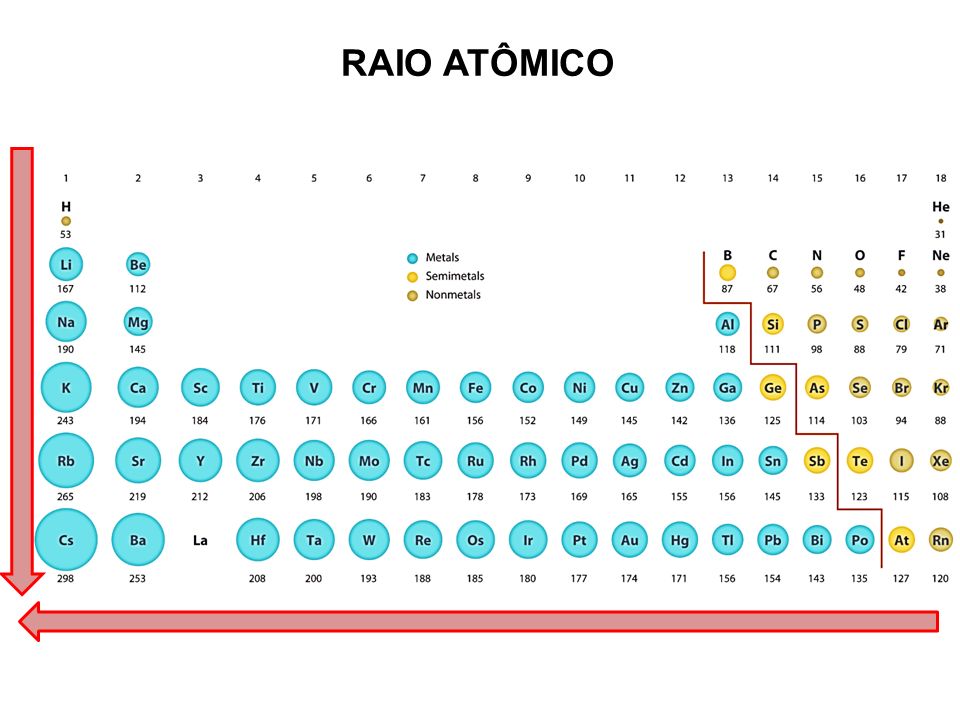
Na tabela periódica, quanto mais a direita da mesma, o raio atômico será menor por causa da eletronegatividade. Importante falar que um átomo eletronegativo é aquele que atrai mais elétrons para si, ou seja, o átomo que tem o raio atômico menor é aquele que tem uma maior força do núcleo exercida aos elétrons, que é a carga núclear efetiva.
Quanto mais a esquerda da tabela, o raio atômico será maior, por causa da eletropositividade, sendo que todo átomo eletropositivo tem a tendência de perder elétrons com facilidade, ou seja, o mesmo terá uma baixa carga núclear efetiva, fazendo com que os elétrons fiquem mais "soltos".
Nenhum comentário:
Postar um comentário