Família 1A e 2A
Quando fazem ligação, a predominância é a covalente sendo assim, geometria é a linear.
Família 3A e 13A
3 ligações, ø não ligantes, geometria trigonal
Família 4A e 14A
4 ligantes, ø não ligantes, geometria tetraêdrica
Família 5A e 15A
3 ligantes, 1 par não ligante, geometria piramidal
Família 6A e 16A
2 ligantes, 2 pares não ligantes, geometria ângular
Família 7A e 17A
1 ligante, 3 pares não ligantes, geometria linear
Química Geral
Aqui neste blog irei postar apenas coisas que envolvam Química Geral do 1º ano do ensino médio.
domingo, 8 de dezembro de 2019
O que é Alotropia?
Alotropia é a propriedade Química que permite a formação de uma ou mais substâncias simples diferentes a partir de um mesmo elemento químico.
Exemplos:
Carbono: o diamante, o grafite e o fulereno são alotropos do carbono e diferem pela forma que os átomos são unidos.
Fósforo: fósforo branco e fósforo vermelhoEnxofre: Enxofre rômbrio e o enxofre monoclínico.
Exemplos:
Carbono: o diamante, o grafite e o fulereno são alotropos do carbono e diferem pela forma que os átomos são unidos.
Fósforo: fósforo branco e fósforo vermelhoEnxofre: Enxofre rômbrio e o enxofre monoclínico.
Ligas Metálicas
Ligas metálicas são materiais com propriedades metálicas que contém dois ou mais elementos químicos sendo que pelo menos um deles é metal.
Elas são criadas a partir do aquecimento entre os componentes da liga até os seus respectivos pontos de fusão, de modo conjunto ou isolado, seguido de esfriamento e solidificação.
Ligas:
Aço: ferro(98,5%) e carbono(0,5 a 1,7%)
Aço inox: é formado a partir do aço comum e apresenta ainda cromo e niquel.
Bronze: cobre e estanho
Ouro 18 quilates: ouro(75%), prata(13%) e cobre(12%)
Latão: cobre(67%) e zinco(33%)
Elas são criadas a partir do aquecimento entre os componentes da liga até os seus respectivos pontos de fusão, de modo conjunto ou isolado, seguido de esfriamento e solidificação.
Ligas:
Aço: ferro(98,5%) e carbono(0,5 a 1,7%)
Aço inox: é formado a partir do aço comum e apresenta ainda cromo e niquel.
Bronze: cobre e estanho
Ouro 18 quilates: ouro(75%), prata(13%) e cobre(12%)
Latão: cobre(67%) e zinco(33%)
terça-feira, 3 de dezembro de 2019
Eletroafinidade
Afinidade Eletrônica ou Eletroafinidade é uma propriedade periódica que indica a quantidade de energia liberada no momento em que um elétron é recebido por um átomo. Esse átomo se encontra sozinho e no estado gasoso.
Basicamente é a energia envolvida no processo de um átomo receber 1 elétron no estado gasoso.
M(g) + e- -> M- (g)
Mede a facilidade de um átomo em ganhar 1 elétron, que futuramente se tornara um ânion.
Afinidade eletrônica pode ser expressa em: Kj/mol ou eletronvolts que também pode ser chamado de potencial.
Basicamente é a energia envolvida no processo de um átomo receber 1 elétron no estado gasoso.
M(g) + e- -> M- (g)
Mede a facilidade de um átomo em ganhar 1 elétron, que futuramente se tornara um ânion.
Afinidade eletrônica pode ser expressa em: Kj/mol ou eletronvolts que também pode ser chamado de potencial.
Energia de Ionização
O átomo ou íon só perderá elétrons se ele receber energia suficiente, que é a energia de ionização.
Na prática, o mais importante é primeiro potencial de ionização ou primeira energia de ionização,
que corresponde à remoção do primeiro elétron. Ela costuma ser a menor
energia de ionização, pois como esse elétron é o mais afastado do
núcleo, a sua força de atração com o núcleo é a menor, precisando de
menos energia e sendo mais fácil removê-lo.
terça-feira, 26 de novembro de 2019
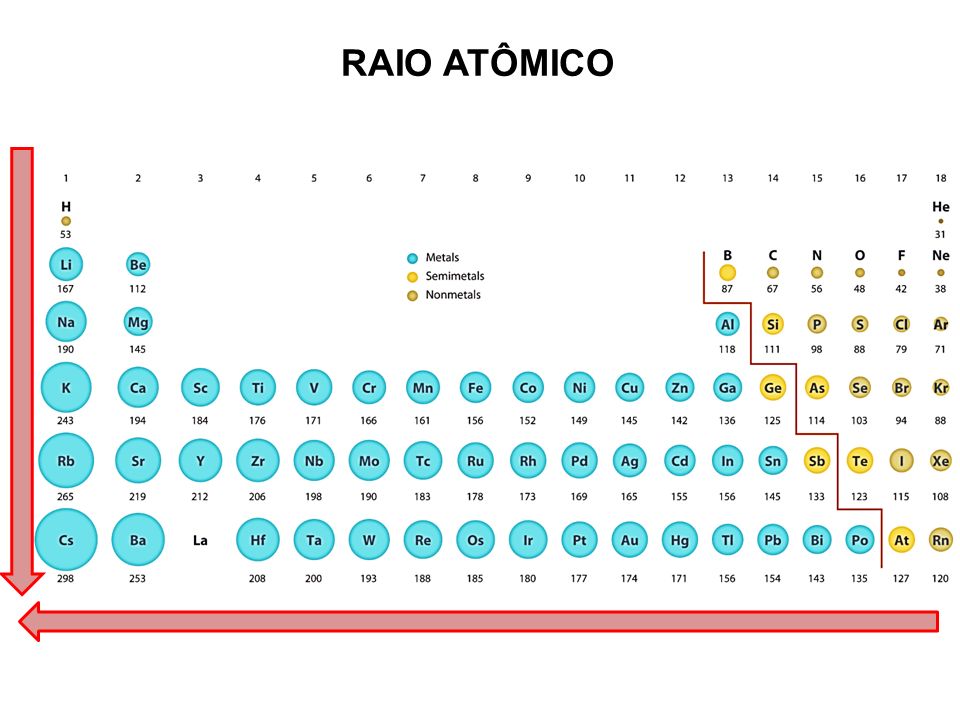
Raio Atômico
O raio atômico nada mais é que a distância do núcleo do átomo à camada de valência, assim como o raio de qualquer outra esfera.
Na tabela periódica, quanto mais a direita da mesma, o raio atômico será menor por causa da eletronegatividade. Importante falar que um átomo eletronegativo é aquele que atrai mais elétrons para si, ou seja, o átomo que tem o raio atômico menor é aquele que tem uma maior força do núcleo exercida aos elétrons, que é a carga núclear efetiva.
Quanto mais a esquerda da tabela, o raio atômico será maior, por causa da eletropositividade, sendo que todo átomo eletropositivo tem a tendência de perder elétrons com facilidade, ou seja, o mesmo terá uma baixa carga núclear efetiva, fazendo com que os elétrons fiquem mais "soltos".
Na tabela periódica, quanto mais a direita da mesma, o raio atômico será menor por causa da eletronegatividade. Importante falar que um átomo eletronegativo é aquele que atrai mais elétrons para si, ou seja, o átomo que tem o raio atômico menor é aquele que tem uma maior força do núcleo exercida aos elétrons, que é a carga núclear efetiva.
Quanto mais a esquerda da tabela, o raio atômico será maior, por causa da eletropositividade, sendo que todo átomo eletropositivo tem a tendência de perder elétrons com facilidade, ou seja, o mesmo terá uma baixa carga núclear efetiva, fazendo com que os elétrons fiquem mais "soltos".

Modelos Atômicos
Os modelos atômicos são os aspectos estruturais dos átomos que foram
apresentados por cientistas na tentativa de compreender melhor o átomo e
a sua composição.
Em 1808, o cientista inglês John Dalton propôs uma explicação para a propriedade da matéria. Trata-se da primeira teoria atômica que dá as bases para o modelo atômico conhecido atualmente.
A constituição da matéria é motivo de estudos desde a antiguidade. Os pensadores Leucipo (500 a.C.) e Demócrito (460 a.C.) formularam a ideia de haver um limite para a pequenez das partículas.
Eles afirmavam que elas se tornariam tão pequenas que não poderiam ser divididas. Chamou-se a essa partícula última de átomo. A palavra é derivada dos radicais gregos que, juntos, significam o que não se pode dividir.

Em 1808, o cientista inglês John Dalton propôs uma explicação para a propriedade da matéria. Trata-se da primeira teoria atômica que dá as bases para o modelo atômico conhecido atualmente.
A constituição da matéria é motivo de estudos desde a antiguidade. Os pensadores Leucipo (500 a.C.) e Demócrito (460 a.C.) formularam a ideia de haver um limite para a pequenez das partículas.
Eles afirmavam que elas se tornariam tão pequenas que não poderiam ser divididas. Chamou-se a essa partícula última de átomo. A palavra é derivada dos radicais gregos que, juntos, significam o que não se pode dividir.

Assinar:
Comentários (Atom)